I enkelte miljøer hevdes det ofte at det å være i ketose er et tegn på at kroppen er i optimal modus for fettforbrenning. Dette brukes som et argument for at ketogene dietter, der energien hovedsakelig kommer fra fett, er det mest optimale for å gå ned i vekt. Men er dette egentlig tilfelle rent biokjemisk? Dette vil jeg drøfte i dette blogginnlegget.

Bilde: Colourbox
Produksjon av ketonlegemer
Jeg har tidligere skrevet om hvordan ketonlegemer produseres og forbrennes (ketonmetabolismen), så en fullstendig repetisjon er ikke nødvendig. Kort fortalt produseres ketonlegemer fra nedbrytning av fett. Endeproduktet fra fettsyrenedbrytning heter acetyl-CoA. Dette molekylet kan enten metaboliseres videre i sitronsyresyklusen og elektrontransportkjeden for å produsere energi, eller kobles sammen med et annet Acetyl-CoA-molekyl og danne ketonlegemer.
Leveren bruker i liten grad fett som energi, så fettsyrene som brytes ned her vil i stor grad brukes til å produsere ketonlegemer. Disse er vannløselige, og fraktes i blodet til målcellene, der de brytes ned igjen til acetyl-CoA og metaboliseres for å frigjøre energi. En stor del av kroppens fettsyrenedbrytning foregår i leveren og omdannes til ketonlegemer, men ettersom disse raskt absorberes av målcellene vil konsentrasjonen i blodet normalt holde seg lav.
Oksaloacetat som begrensende faktor
Acetyl-CoA er substrat for sitronsyresyklusen, som produserer de elektronbærende molekylene NADH og FADH2. Disse går inn i elektrontransportkjeden og frigjør energi til nyproduksjon av kroppens primære energimolekyl adenosintrifosfat (ATP). Bildet under viser en skjematisk oversikt over sitronsyresyklusen. Legg merke til antallet karbonatomer i de ulike forbindelsene. Acetyl-CoA består av to karbonatomer, og i løpet av en runde i sitronsyresyklusen forsvinner to karbonatomer i form av CO2.
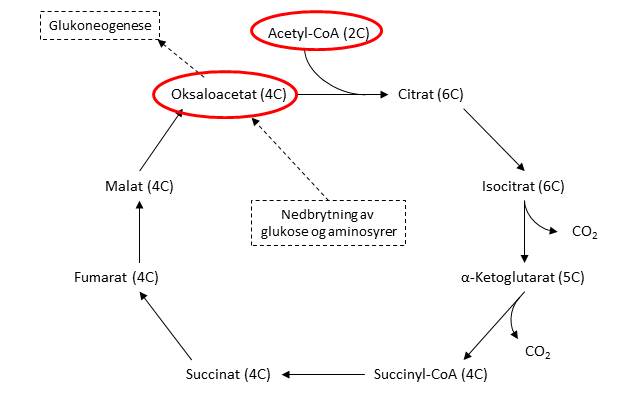
Sitronsyresyklusen, med oversikt over antall karbonatomer og metabolisme av oksaloacetat.
For at Acetyl-CoA skal gå inn i sitronsyresyklusen, må det kobles til oksaloacetat. Det er altså mengden oksaloacetat som er av betydning for hvor mye Acetyl-CoA som kan metaboliseres denne veien. Ettersom to karbonatomer kommer inn og like mange forsvinner for hver runde i syklusen, så får vi ikke en økning i mengden metabolitter som som følge av fettsyrenedbrytning.
Oksaloacetat kan produseres fra pyruvat, som er endeproduktet i glykolysen. Eventuelt kan vi produsere oksaloacetat ved nedbrytning av glukogene aminosyrer, men først og fremst kommer dette fra nedbrytning av glukose. Tilstrekkelig aktivitet i glykolysen er altså nødvendig for at vi skal kunne utnytte energien fra Acetyl-CoA fullt ut.
Ketose og ketogene dietter
Når mengden ketonlegemer i blodet øker så sier vi at vi er i ketose. Ketogene dietter er kosthold som tar sikte på nettopp dette, ved å begrense inntaket av karbohydrater. Som nevnt over vil et begrenset inntak av karbohydrater være en begrensende faktor for produksjonen av oksaloacetat, og dermed begrenser vi også kapasiteten for å forbrenne ketoner. Et lavt inntak av karbohydrater vil også medføre lavere insulinnivåer, noe som øker frigjøringen av fettsyrer fra fettvevet. Disse fettsyrene fraktes til leveren hvor de brytes ned, og dermed øker produksjonen av Acetyl-CoA. Figuren under viser hvordan ketlegemene fraktes mellom blodet og cellene .
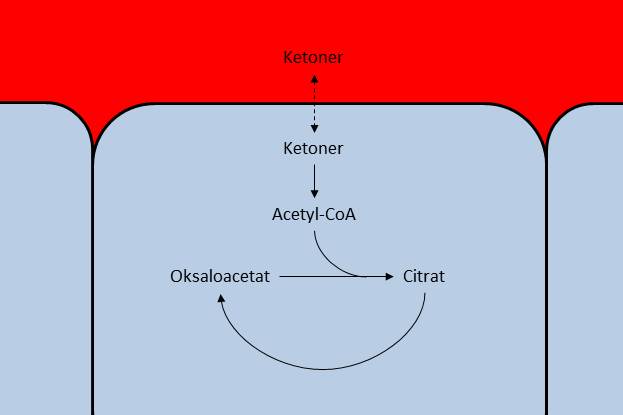
Ketonlegemene diffunderer fra blodet og over i cellene. Når mengden oksaloacetat reduseres, vil mindre ketoner tas opp av cellen, og konsentrasjonene i blodet øker.
Grunnen til at konsentrasjonen av ketonlegemer i blodet øker som følge av dette er todelt. For det første har vi en økt produksjon av ketonlegemer i leveren, og dermed også en økt eksport av disse til blodet. Redusert aktivitet i glykolysen og dermed redusert produksjon av oksaloacetat i målcellene gjør at tilførselen av Acetyl-CoA overgår kapasiteten for å metabolisere det videre, noe som gjør at konsentrasjonen av Acetyl-CoA inni målcellene øker. Som en konsekvens av dette vil opptaket av ketonlegemer fra blodet til målcellene reduseres, og da øker konsentrasjonene i blodet.
Når konsentrasjonen av ketonlegemer i blodet øker, så vil vi også etter hvert skille disse ut gjennom urinen, og vi kan påvise økte nivåer av ketonlegemer både i blod og urin. Dette kalles altså å være i ketose. Noe vil også skilles ut via pusten som aceton.
Kostindusert og sultindusert ketose
Kostindusert ketose kan oppnås ved å spise tilstrekkelig lite karbohydrater, grunnet mekanismene nevnt over. Siden vi har en del celler som er avhengig av glukose som energikilde, og at kroppen derfor prioriterer å opprettholde blodsukkeret, vil leveren sette i gang egenproduksjon av glukose gjennom glukoneogenesen. En forløper for nydanning av glukose er glycerol fra nedbrytning av triglyserider, mens en annen er oksaloacetat. Ved økt aktivitet i glukoneogenesen vil vi altså tappe nivåene av oksaloacetat, noe som ytterligere reduserer kapasiteten for å metabolisere Acetyl-CoA. Denne mekanismen er illustrert med piler i figuren under.
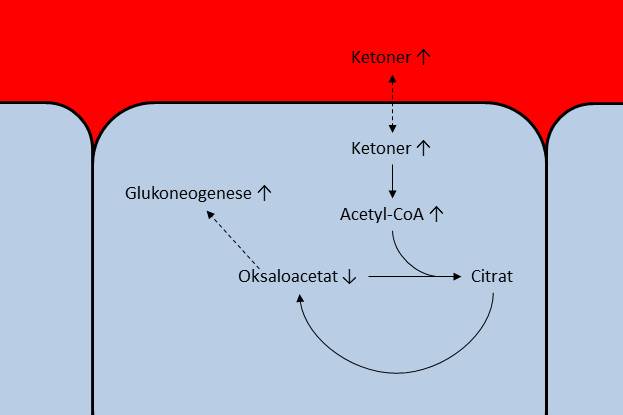
Når glukoneogenesen fører til tapping av oksaloacetat får vi en opphopning av Acetyl-CoA og ketoner inne i cellen, og dermed en økning av ketonkonsentrasjonen i blodet.
Ved sult vil vi rimelig raskt komme inn i en kraftig ketose. Glykogenlagrene i leveren vil tømmes, mens glukoneogenesen vil stå på for å produsere glukose til de cellene som trenger det. Nedbrytningen av fett vil være høy som følge av at kroppen har et høyt energibehov, og dette medfører en kraftig økning i produksjonen av ketonlegemer.
Målbar ketose i blod og urin – optimal fettforbrenning?
Tilbake til påstanden fra starten av innlegget. Betyr ketose at fettforbrenningen er optimal? Fra et biokjemisk standpunkt stemmer ikke dette, da ketose er et tegn på at fettsyrenedbrytningen er større enn vi har kapasitet til å metabolisere videre. Ketonlegemene vi måler i blod og urin er et tegn på at vi overskrider denne kapasiteten, og vi henter altså ikke ut så mye energi fra fettsyrene som vi kunne gjort, og energi går tapt ved å skille den ut i urinen og noe ved pusten.
Det er ikke dermed sagt at å være i ketose er negativt. Dette kan for eksempel bidra til å øke mengden fett som forlater kroppen, noe som gjør at en slik diett kan være effektivt for vektnedgang. At lavkarbodietter i studier viser seg å gi en spontan reduksjon i energiinntaket støtter opp om dette. Det er også indikasjoner på at ketonlegemene i seg selv kan ha gunstige effekter, deriblant virke oppkvikkende. Dette gir mening evolusjonært, da opphopning av ketonlegemer er et tegn på redusert tilgang på mat og det å være våken og tenke klart er en fordel for å fremskaffe mat. At ketogene dietter viser en viss suksess hos medisinresistente epileptikere er et annet tegn på at ketonlegemer kan ha gunstige effekter.
Alt i alt er det absolutt en plass for ketogene dietter i visse tilfeller, selv om påstanden om optimal fettforbrenning ikke nødvendigvis kan sies å være korrekt rent biokjemisk. Jeg vil personlig ikke anbefale disse diettene på generelt grunnlag, men i mange tilfeller er det heller ikke spesielt mange argumenter for å fraråde det dersom man ønsker å spise slik. Friske personer kan overleve og klare seg fint på et bredt spekter av ulike kosthold, og så lenge man dekker behovene for de ulike næringsstoffene er jeg av den mening at folk selv bør kunne bestemme hvordan de vil spise. Når det gjelder kostholdsanbefalinger til syke personer, bør dette vurderes i hvert enkelt tilfelle i samråd med behandlende lege.
Fin artikel Vegard! Men slik jag tänker så omhandlar artikeln egentligen bara den första fasen av en ketogen diet (de första veckorna). Denna bild förändras etterhvert da metabolismen anpassar sig till rådande makronutrientsammansättning (eller energitillgang).
Som du skriver har vi en massiv fettförbränning vilket orsakar höga nivåer av ketoner i urin och blod. Ketonerna i urin kan man väl kalla för «överskottsketoner». Men i förlängningen av detta tillstand vil kroppen anpassa sig. Behovet av glukoneogenes minskar feks. Tillgång på oxaloacetat ökar. Man snackar om «ketoadaption» altså vår förmåga att tillgodogöra oss ketoner. Denna ökar. Ökningen av ketonförbränning återspeglas logiskt nog i en minskning av överskottsketoner målt i urin som med tiden inte ens behöver ge utslag längre. Det betyder dock ikke att man är i mindre ketos, men att man närmar sig homeostas mellan produktion och förbruk av ketoner. För om man måler ketonnivåen i blod så är den fortsatt skyhög.
En annan sak man sett är väl feks att betaoxidationkapaciteten i speciellt muskelceller ökar så att mer fett kan förbrännas direkt utan att gå via ketos och ketolys..
Interessant innspill!
Høye ketonnivåer i blodet vil uansett være en konsekvens av at ketonproduksjonen overgår kapasiteten til å metabolisere ketonene.
Det er ingen tvil om at det skjer tilpasninger, og økt betaoksidasjon er en av disse. Men betaoksidasjonen gir opphav til acetyl-CoA, som er avhengig av oksaloacetat for å forbrennes oksidativt. Det er altså tilgangen på oksaloacetat som er det vesentlige her, ettersom dette avgjør i hvor stor grad vi må produsere ketonlegemer. Tilførsel av oksaloacetat skjer ved nedbrytning av glukose eller aminosyrer. Det er riktig at behovet for glukose vil reduseres etterhvert, noe som legger en brems på glukoneogenesen.
Økt mengde acetyl-CoA gir også mer substrat til fettsyresyntese og kolesterolsyntese, så det er flere involverte metabolske prosesser. 🙂
«Høye ketonnivåer i blodet vil uansett være en konsekvens av at ketonproduksjonen overgår kapasiteten til å metabolisere ketonene.»
Ikke helt enig i den. Min oppfattning är att etterhvert så uppstår homeostas här. Man kan etterhvert ha en steady state ketonkoncentration på tex 2,5 mmol/L i blod men knappt märkbar nivå i varken urin eller utpust. Hvis det hade vart större produktion är nedbrytning hade vi målt högre nivåer i utpust och urin? Min förståelse av detta är att man da oppnått likevekt mellom produktion och förbruk. Behovet av glukose är nå på sitt laveste, liksom gluoneogenesen och dess förbruk av oxaloacetat, liksom nedbrytning av aminosyror. CNS livnär sig till stor del av ketoner, muskler bruker noe ketoner men till större del fettsyror i blod och intramuskulärt lagrade triglycerider..
Sånn kan man også se det selvfølgelig, men i utgangspunktet så er det jo slik at ketonene ikke hoper seg opp i blodet med mindre man produserer mer enn man kan bruke. De diffunderer veldig lett inn i cellene med mindre konsentrasjonen av ketoner eller acetyl-CoA inne i cellen er høy. At man kan ha høye nivåer i blod uten at det skilles ut i urin syns jeg høres rart ut, da hele blodvolumet filtreres i nyrene mange ganger om dagen. Er konsentrasjonen av ketoner i blodet høy så vil også noe nødvendigvis skilles ut i urin, det er jo det som skjer når konsentrasjonen i blodet øker.
Jeg ser poenget ditt, men har du noe informasjon om dette med å ha høye ketonnivåer i blod uten at det er målbart i urin?
Jag hade ikke brukt ordet «opphopning» like lite som jag ville kallt glukosekoncentrationen hos en frisk kolhydratdreven person för opphopning av glukose. Makronutrienterna ändras fundamentalt och etterhvert stabiliseras metabolismen på helt andra parametrar. En kolhydratdreven person har mye mindra ketonkoncentration i blodet siden han huvudsakligen bruker kolhydrater som energikälla. Men en fettdreven person har konstant högre ketonkoncentration i blodet siden den personen huvudsakligen bruker fett som energikälla. Om mestparten av dessa energitäta ketonerna hade kommit ut i urinen hade ju ikke personen fått i sig noen energi och fort drabbats av underernæring. Man kan ikke jämföra ketonnivåer på ca 0,5 mmol/L hos en kolhydratdreven person med 3,0 mmlol/L hos en fettdreven person. Muliggens hade jag kallt det för opphopning om en kolhydratdreven person plutsligt hade 3,0 mmol/L med ketoner i blodet..
Ska se om jag kan finna fram noe på detta å sende nästa uke.. är i thailand akkurat nu :)..
Annars kan man faktiskt beställa en sån här sak för en billig peng och testa detta på sig selv..
Keton och BS mätare:
http://www.ebay.com/itm/GlucoMen-LX-Plus-Glucose-Keytone-Meter-/331065434287?pt=UK_Health_Beauty_Mobility_Disability_Medical_ET&hash=item4d1509a0af
Och seff noen vanliga urinstix för att mäta ketonerna i urinen.
Forskjellen ligger i hva som skjer i nyrene. Vi har en effektiv reabsorbsjon av glukose, så all glukose som filtreres reabsorberes slik at ingenting skilles ut. Blodnivåene av glukose må over 10mmol/L før det begynner å lekke ut i urinen, dvs at reabsorbsjonskapasiteten er mettet. Dette er jo grunnen til at man tidligere diagnostiserte diabetes ved å smake på urinen om den smakte søtt.
Når det gjelder ketoner så har vi ikke effektive reabsorbsjonsmekanismer, og det er grunnen til at ketonene skilles ut i urinen når blodnivåene øker. Normalt sett diffunderer ketonene så lett inn i cellene at blodnivåene er veldig lave. Når innfluks til cellene reduseres og blodnivåene øker, så vil utskillelsen over nyrene også øke.
Her skriver kostdoktoren om forskjellige nivåer av ketoner i blodet. Er det dette David vil frem til? http://www.kostdoktorn.se/ga-ner-i-vikt-med-optimal-ketos
Jeg vet du elsker forsøk gjort på en person, så jeg legger med denne også 🙂
http://www.kostdoktorn.se/slutrapport-tva-manaders-strikt-lchf-och-ketonmatning
Poenget er at det kanskje har noe å si med mengden ketoner?
Viktig forskjell där, Vegard, Kanske litt dålig jämförelse med blodsocker!
Just, henriette. Begräppet «optimal ketos» blev slikkelig på mote för ett år sen typ husker jag.. Sen tror jag 5:2 tok over hehe 😉
Men ja, grafen till den enkelpersoner verkar visa en tendens att mindre ketoner släpps ut i urinen med tid selv om blodkoncentrationen är hög.
En annan ting.. Det är väl just pga ketoadaption som glukoneogenesen etterhvert kan reduceres med «hensikt» att reducera forbruket av aminosyrer.. Glukoseproduktionen blir mindre och kanske till stor det går att underhålla med substrat fra den stora fettnebrytningen -glycerol.
Blir kanske litt mye teoritiskt plausibla sammanhang här och anekdotiska uppgifter, men ska se om jag finner noe mer konkret på det när jag kommer hem 🙂
Nå er det lenge siden jeg tok titt på dette, men i farten så mener jeg å huske at tap av ketoner via urin, pust og svette var i gjennomsnitt totalt rundt 25 +/- kalorier per dag, hvorav urinen var den største kilden ved en fullstendig «ketoadapsjon.»
Dette ville jeg anta ville vært målbart i urinen.
La oss bara se på den energin CNS bruker per dygn. 70-80% av det kan så småningom ersättas av ketoner. Detta är ketoner som innan ketoadaption hade kommit ut i huvudsak via urinen. Så bara CNS´s ketoadaption borde innebära en ganska drastisk ökning av kroppens förbruk av ketoner?
Forbruket av ketoner vil helt klart øke, og dette vil redusere behovet for nydanning av glukose. Men med mindre nyrene begynner å reabsorbere ketonene så ser jeg ingen måter blodnivåene kan fortsette å være høye uten at ketonene fortsetter å skilles ut i urinen. Så da er spørsmålet, vil nyrene begynne å reabsorbere ketonlegemer etterhvert?
Som du ser av forsøket til Eenfeldt så følger urinutskillelsen blodkonsentrasjonen ganske stabilt. Avvikene kan komme på grunn av måletidspunkt, hydreringsgrad osv.
Det är en bra poäng! Det ser ut som att det skjer många förändringar i njurarna hos den ketoadapterte. Bl.a. förändras utskillelsen av natrium, vann och magnesium (och säkert andra mineraler).. Många av de tidiga bieffekterna tror ha ett samband men natrium och magnesium förlust.
Jag husker att Annika Dahlqvist skrev att återupptaget av ketoner i njuren ökar hos den ketoadapterte.
Jeff Volek och Stephen Finney skriver oxå om komplexa förändringar i njuren hos den ketoadapterte i «The Art and Science of Low Carbohydrate Living» bl.a. på sidan 164-166 som föreslår minskad renal utskillelse av ketoner. De referer bl.a. till en studie fra -70 som heter Starvation in man, som publisertes i NEJM (har ikke sett på den).
Men å andra sidan.. Det ser ut som att med tiden så förbrukar muskeller mindre och mindre ketoner (etterhvert som CNS blir ketoadaptert) och reducerar i ökande grad acetoacetat till b-hydroxybutyrat (som är CNS foretrykne energikälla) som släppt ut i cirkulationen igen. Och de flesta urinstixen måler väl bara acetoacetat? Så stixen kan oxå vara en felkälla.. Det kan vara mer ketoner (b-hydroxybuturat) som läcker ut i urin än stixen skulle tilsi..
Men jag skulle tro att summa summarum så blir det i allafall noe mindre ketoner i urin pga ökat förbruk (ketoadaption) och eventuellt minskad renal uskullelse…
«keto-adaptation» är tyvärr inte det sökordet som får flest träff på pubmed 🙂
For ordens skjyld:
«Forearm muscle metabolism was studied in eight obese subjects after an overnight, 3 and 24 day fast… free fatty acids, acetoacetate, and beta-hydroxybutyrate with simultaneous forearm blood flow were measured. Rates of metabolite utilization and production were thus estimated. Acetoacetate and beta-hydroxybutyrate consumption after an overnight fast was low. At 3 days of fasting with increased arterial concentrations of acetoactate and beta-hydroxybutyrate, consumption of these substrates rose dramatically. At 24 days of fasting, despite further elevation of arterial levels of acetoacetate and beta-hydroxybutyrate, the utilization of acetoacetate did not increase further and if anything decreased, while five out of eight subjects released beta-hydroxybutyrate across the forearm. Acetoacetate was preferentially extracted over beta-hydroxybutyrate. At 24 days of starvation, free fatty acids were the principal fuels extracted by forearm muscle; at this time there was a decreased glucose and also ketone-body consumption by skeletal muscle»
http://www.ncbi.nlm.nih.gov/pubmed/5090067
Fant noe här som bekräftar det Daniel skriver om den lilla mängd ketoner tapt i urin hos den ketoadapterte:
«This adaptation is associated with a small loss of the ketoacids into the urine (100-150 mM/day or 40-60 calories/day).»
http://www.ncbi.nlm.nih.gov/pubmed/7029558
David Ersarve har helt rett i at langvarig høyfett-/lavkarbokosthold gjør at flere vev tilpasser seg bruk av ketoner. Jeg trodde som ham at hjernens mulighet til å bruke ketoner som erstatning for glukose var ca. 70-80 %, men forskning utført av Drenick mfl. viste allere i 1972 at man kan fungere utmerket med et glukosnivå i blodet på 0,5-1 mmol/L eller inntil 1/10 av det som regnes som normalt. Artikkelen finner du her: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC332976/
Forfatterne konkluderer at ketoner kan erstatte (kanskje all) glukose i nervesystemet, og flere evolusjonsforskere som har studert omsetningen av energisubstrater under faste eller ved inntak av mye fett, konkluderer at mennesket ikke bare er evolusjonært godt tilpasset ernæringsindusert (eller faste-) ketose, men at ketoner kan kalles et «superbrensel» fordi det gir mer ATP enn noe annet substrat. Det gir oss med andre ord mer energi, ikke mindre, slik Vegard antyder. I parentes bemerket har jeg målt omkring 5,2 mmol/L ketoner i blodet og kan trene hardt på tom mage…
Slik karakteriserer Richard L. Veech (Prostaglandins, Leukotreienes and Essential Fatty Acids 2004; 70: 309-19) de terapeutiske implikasjonene til ketoner: «Among the common non-nitrogenous substrates for mitochondrial energy generation, ketone bodies deserve the
designation of a ‘‘superfuel’’.
En tilstand av kronisk, ernæringsindusert ketose er etter alle solemerker ikke bare gunstig ved epilepsi eller andre nervelidelser, men for alle som ønsker å holde hodet klart og å unngå de skadelige virkningene av store blodsukkersvingninger.
:-), jeg klarer fint å løpe 5 km på mølle på 25 minutter på tom mage i ketose ❤️
Jeg har da aldri antydet at ketoner gir verken mer eller mindre energi enn noe annet substrat… Et ketonlegeme gir 2 molekyler Acetyl-CoA, med den ATPen det muliggjør gjennom forbrenning gjennom sitronsyresyklusen og elektrontransportkjeden. På samme måte som forbrenning av ett molekyl glukose gir to Acetyl-CoA og forbrenning av fett gir 1 Acetyl-CoA for hver syklus i betaoksidasjon. Det jeg argumenterer for er at et høyt nivå av ketoner i blodet/urin er et tegn på at produksjonen av ketonlegemer er større enn kapasiteten for å metabolisere dem, for i utgangspunktet diffunderer de ekstremt lett inn i cellene.
Den studien du linker til viser forøvrig ikke at man kan fungere på 0,5-1 mmol/L blodglukose. For det første så snakker vi om 9 personer som har fastet i 60 dager, altså ikke nødvendigvis særlig overførbart til noen egentlig. I tillegg så er denne blodglukosen målt i perioden etter en insulinbelastningstest. Det var altså ikke sånn at disse gikk rundt og hadde så lave blodsukkerverdier, men de ble målt til så lave etter å ha tilført insulin. Det man imidlertid så, var at etter fasteperioden, når disse personene var i en ekstremt sultindusert ketose, så gav ikke denne insulinbelastningen symptomer på hypoglykemi, og det diskuteres hvorvidt tilpasning til å bruke ketoner som energisubstrat gjorde at man var mer motstandsdyktig mot nettopp dette.
I alle tilfeller kan du på ingen måte bruke denne studien til å si at man kan fungere utmerket på så lave blodglukoseverdier.
Du nevner epilepsi, men unnlater å nevne at ketogen diett bare gir symtomfrihet hos omlag halvparten av medikamentresistente epileptikere.
Jeg har forøvrig ikke et vondt ord å si om ketoner som energisubstrat, det er ikke meningen å gi uttrykk for om det jeg skriver på noen måte kunne tolkes i den retningen.
Hei igjen; Det du skriver om kroppens evne til å bruke ketoner, er ikke helt korrekt. For det først gir ketoner MER energi enn andre for eksempel glukose, hvilket er årsaken til at bruken av ketoner er spesielt gunstig i nervevev, hvor ketoner kan erstatte glukose (som dessuten er mer reaktivt). For det andre er det feil at et høyt ketonnivå i blodet betyr at kapasiteten til å nedbryte dem er overskredet. Husk at et normalt blodglukosenivå ligger på 4-5,5 mmol/l, omtreng på samme nivå som ketoner etter ketotilpasning (2-4 uker på høyfettkosthold eller faste). Energisubstrater må alltid være til stede i blodet i en viss konsentrasjon for at cellene skal ta dem opp, og et ketonnivå på 5-7 mmol/L betyr IKKE at deler går til spille. Mitt tredje poeng var at forsøk har vist at man kan fungere utmerket med et glukosenivå i blodet ned mot 0,5 mmol/L. Forsøkspersonene fikk ingen av de symptomene de opplevde med mye høyere glukosenivå FØR de var ketoadaptert. Det betyr ikke at dette er en normalsitusjon, men evolusjonært har våre forgjengere vært gjennom perioder med sult og/eller ekstremt høyfettkosthold og har fungert bra nok uten mat (med et høyt nivå av ketoner i blodet) til å videreføre sine gener. De nevnte forsøkspersonene var følgelig ikke i en «ekstrem sultindusert ketose», de var i en tilstand som mange av våre forgjengere må ha møtt mange ganger, altså normalt. Her må vi konstatere uenighet. Jeg vil anbefale deg å lese den utmerkede artikkelen til VanItallie og Nufert (2003) «Ketones: Mtabolism´s ugly duckling» (Nutrition Reviews, 61 (10): 327-41). Der finner du også biokjemiske forklaringer som avviker fra dine og rotteforsøk som viste at dersom man introduserte ketoner i perfusjonerte hjerter, fant de en 16-ganger økt acetyl-CoA-konsentrasjon og økt konsentrasjon av Krebs-syklus- metabolitter. Måling av hjertets pumpekapasitet viste en sterk, siginificant økning sammenliknet med bare glukose. Dette viser at et normalt høyt ketonnivå gir en mer effektiv ATP-produksjon enn glukose…
Når det gjelder epilepsi, er høyfettkosthold fortsatt minst like effektivt som medikamenter til tross for at farmasøytisk industri har hatt nærmere 90 år på seg for å komme opp med noe bedre, hvilket de altså ikke har klart. I mange tilfeller hvor medikamenter ikke hjelper, har høyfettkosthod vist dramatisk bedring på kort tid. Det tilsier at høyfettkosthold bør forsøkes først – og kanskje at mange aldri ville opplevd epileptiske anfall, dersom de hadde fått høyfettkosthold også etter at de sluttet med fettrik morsmelk.
Jeg snakker om ett ketonlegeme vs ett glukosemolekyl. Begge disse brytes ned til hhv. 2 molekyler Acetyl-CoA. Du snakker om total produksjon av ATP.
Angående ketoner i blodet så holdes disse lave normalt sett på tross av en høy produksjon fordi de diffunderer så fort inn i målcellene. Når konsentrasjonen av acetyl-CoA inni cellene øker så reduseres transporten inn i cellene og nivåene i blodet øker. Da vil også ketoner skilles ut i urinen, ettersom de filtreres i nyrene. Hva som skjer med en eventuell reabsorbsjonsfunksjon i nyrene over tid vet jeg ikke, men jeg er ikke fremmed for at nyrene kan tilpasse seg og begynne å reabsorbere ketoner etterhvert.
Og igjen, denne målingen ned mot 0,5 mmol/L glukose var rett i etterkant av en insulinbelastning hos mennesker som hadde fastet i 60 dager. Det var ikke glukosenivåer disse gikk rundt med. Du har derfor ikke noe grunnlag for å hevde at disse peronene fungerte utmerket med slike glukosenivåer.
Det eneste du kan si er at ved å være i kraftig ketose så viste denne studien at en senking av blodsukkeret ikke gav symptomer på hypoglykemi, som de samme personene opplevde før fasteperioden, og at det dermed indikerer at ketosen kan virke beskyttende mot disse symptomene.
Hvis du ikke mener at 60 døgns faste ikke vil gi en ekstrem sultindusert ketose så må vi nok si oss enige om å være uenige. Du kan argumentere for at det kan ha vært en aktuell situasjon for våre forgjengere, hvertfall tidvis, men det er hvertfall ikke en normalsituasjon for oss mennesker i dag!
Ang de rotteforsøkene du nevner: at de fant høyere intracellulære nivåer av acetyl-CoA er derfor ikke overraskende, men svært logisk fysiologisk sett. Hjertet bruker også i stor grad ketoner som energi i utgangspunktet, så det med ATP-produksjonen her er heller ikke et overraskende funn.
Interessant diskusjon i alle tilfeller 🙂
Dag V P: Jeg har selv hatt oppfølging med personer som har brukt ketogendiett ved alvorlig epilepsi og de hadde gode resultater, MEN dietten var et helvete å følge for foreldrene, helsepersonell, barnehagepersonell etc. Noen dager når det hadde blitt litt avvik var natta som fulgte skikkelig tragisk og foreldrene måtte holde vakt for å passe på hos en av jentene. Imidlertid vurderte et av foreldreparene at de syntes det var verdt det da epilepsien som helhet hadde blitt noe over 50% bedre (totalt fravær av de verste episodene, men fremdeles endel lette etter å ha fulgt dietten i flere måneder).
Jeg kjørte selv ganske strikt lavkarbo en lengre periode og må vell konkludere med at energinivået sjelden har vært så lavt, jeg vet ikke hvor mange måneder man trenger for å tilpasse seg, men jeg gav opp etter ca 6 mnd. Pr idag spiser jeg vell rundt 20-30% protein, 30-40% karbohydrater og 40-50% fett og trives godt der. Vi er forskjellige og godt er det, noen har jo evolusjonert tilpassa seg et ganske høyt karbonivå og som kitavaerne (og flere andre øyer i sørøst-asia og okinavaerne, men mye av helsa deres ligger kanskje i at de bruker andre karbokilder med generelt lav glykemisk indeks (svært lite korn, raffinert sukker og melkeprodukter), spiser bra med fisk og har et særdeles lite stressende liv 🙂
Beklager hvis det er et dumt spørsmål, men hvis jeg forstår rett, står det i en av kommentarene at glukoneogenesen stopper opp ved ketose etter tid… men glukoneogenesen vil vel fortsette å omdanne aminosyrer til anvennelig glukose, eller har jeg fullstendig misforstått det med glukoneogenese?